-
Compteur de contenus
13 394 -
Inscription
-
Dernière visite
-
Jours gagnés
453
Type de contenu
Profils
Forums
Blogs
Galerie
Boutique
Tout ce qui a été posté par Barbidoux
-
Dans un repère orthonormé on peut considérer les trois point A{0,0} , B{4,0} et M{x,y} du plan . Des coordonnées vect{MA}{ -x,y} et vect{MB}(4-x,y} on déduit que : vect{MA}. vect{MB}=x^2-4*x+y^2 1———————— Ensemble des points tels que vect{MA}. vect{MB}=-4 ==> x^2-4*x+y^2=-4 ==> (x-2)^2+y^2=0 cercle de centre {0,2} et de rayon nul donc point P 2———————— Ensemble des points tels que vect{MA}. vect{MB}=2 x^2-4*x+y^2=2 ==> (x-2)^2+y^2=6 cercle de centre P{0,2} et de rayon √6 1———————— Ensemble des points tels que vect{MA}. vect{MB}=-5 ==> (x-2)^2+y^2=-1 ensemble vide
-
Etude du rayonnement réfléchi par la surface d'une planète (réflexion). Permet d'estimer à partir de la valeur du taux de réflexion, la nature de son écosystème et de sa température moyenne.
-
On prévoit la nature de l'écosystème d'une planète en fonction du taux de réflexion du rayonnement qu'elle reçoit. Par exemple La planète Tatooine doit avoir un taux de réflexion voisin de 31% du rayonnement qu'elle reçoit voisin de celui du sable ce qui laisse présager que sont écosystème est voisin de celui du sable donc désertique. Plus le pourcentage de rayonnement réfléchi est élevé plus la température est basse...
-

[CNED] première, devoir 4 Physique-Chimie
Barbidoux a répondu à un(e) sujet de Baptiste07 dans Sciences
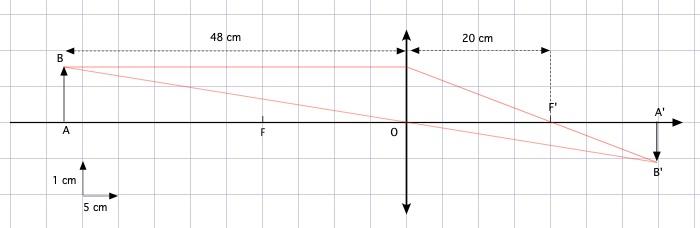
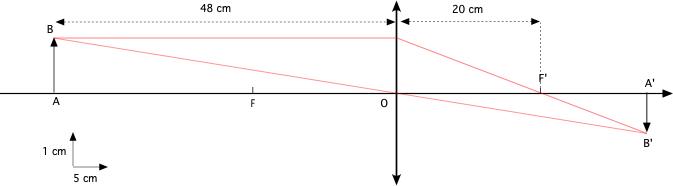
Voilà un schéma avec grille qui sera peut être plus parlant, la vergence de la lentille étant égale à 5 sa distance focale vaut 1/5 m soit 20 cm. -

[CNED] première, devoir 4 Physique-Chimie
Barbidoux a répondu à un(e) sujet de Baptiste07 dans Sciences
-
E32=E3-E2=-3.73+4.99=1.26 eV=1.26*1.602*10^(-19) J=2.0185*110^(-19) J ∆E=h*nu=h*c/Lamda ==> Lamda =h*c/∆E=6.63*10^(-34)*3.00*10^8/(2.01852*10^(-19))=9.85*10^(-7) m=985 nm désexcitation de l’atome avec émission d’un photon 2a————— Elle correspond à l’excitation de l’atome lorsqu’il passe de E0 à E1. soit E10=E1-E0=10.44 - 5.54=4.9 eV=4.9*1.602*10^(-19) J=7.850*10^(-19) J 2b————— Lamda = 6.63*10^(-34)*3.00*10^8/(7.8498*10^(-19))=2.533*10^(-7) m=253 nm nu=∆E/h=7.8498*10^(-19)/(6.63*10^(-34))=1.183*10^15 Hz 2c————— Passage de l’atome d’un niveau d’énergie stable E0 à un un niveau d’énergie de plus grand état d’excitation 3————— 683 nm ==> E=1.817 eV transition entre les niveaux 3 et 1 4————— Une radiation lumineuse de longue d’onde 110 nm transporte un énergie égale à 11.287 eV. Cette énergie ne correspond à aucune transition possible dans l’atome de mercure. Elle n’est donc pas capable d’exciter l’atome de mercure
-
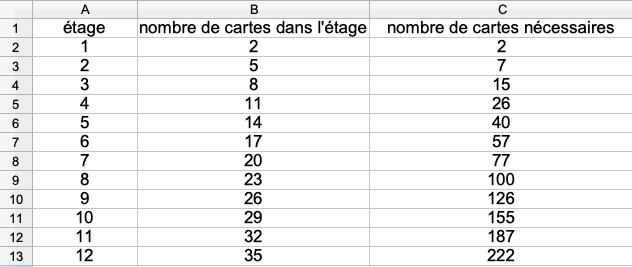
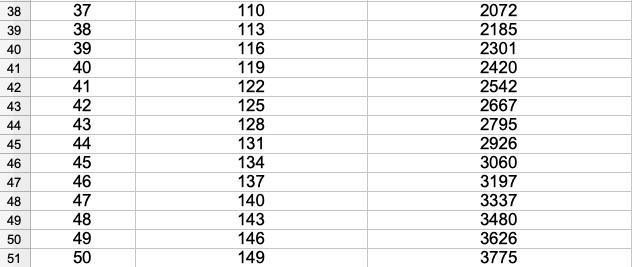
Tu peux utiliser un tableur dans A3 tu entres =A2+1 dans B3 tu entres =B2+3 dans C3 tu entres =C2+B3 Tu remplis (ou propage) le contenu des cellules A3, B3, C3 vers le bas jusqu’à obtenir le cinquantième étage
-
-
les calculs sont à effectuer
-

Dosage de l’anhydride sulfureux SO2 dans un vin mousseux
Barbidoux a répondu à un(e) sujet de loulou34212 dans Sciences
la concentration volumique d'une espèces en solution s'exprime en mol/L alors que la concentration massique massique s'exprime soit en g/l soit en % -
tu oublies les unités des grandeurs que tu utilises. Une relation physique doit être homogène vis à vis de unités a^3=4*m/rho si rho est en kg/m^3 alors il faut que m soit en kg pour que le résultat soit correct puisque a^3=kg/(kg/m^3)=m^3 Non c'est toi qui la commets, toujours les problèmes d'unité 1,67 x 10-27c'est le nombre qui représente la masse de l'unité de masse atomique exprimée en kg la masse volumique est le rapport d'une masse et d'un volume, on sait que la maille est un cube, soit a sont côté alors le volume de la maille vaut donc a^3. Elle contient 4 atomes de masse 4*m sa masse volumique vaut donc rho=4*m/a^3 et a=(4*m/rho)^(1/3)
-
par la racine cubique ou la puissance 1/3 a=(6.867*10^-29)1/3=4.10*10-10 m
-
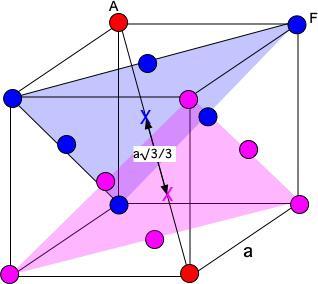
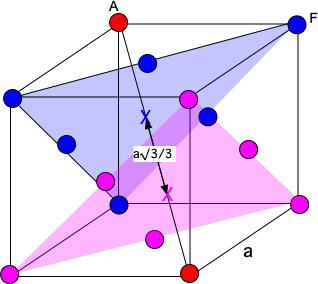
---------------- 3. Rappeler la valeur de la compacité d’une maille c.f.c. et utiliser sa définition pour démontrer que le paramètre a de la maille est 400 pm (3,5 pts). Toute autre démonstration n’utilisant pas la définition et la valeur de la compacité est acceptée. ---------------- De la relation a= (4*m/rho)^(1/3)==(4*3.27*10^(-25)/19047.5)^(1/3)=4.095 10^(-10)m=409.5 pm ---------------- 4. Les atomes d’or sont disposés en couches ABCABC. Calculez la distance entre deux plans consécutifs d’atomes d’or au contact. (1,5 pts) ---------------- d=a√3/3
-
pas d'erreur, la densité de l'or est bien voisine de 19.
-
rho=m/V est en général une lettre grecque représentant en physique la masse volumique , rapport d'une masse et d'un volume
-

exercice de "etude d'une suite" et "proprieté de a"
Barbidoux a répondu à un(e) sujet de koukolo dans Mathématiques
va voir là -
——————————— Partie B ——————————— 1——————————— en semaine de rang n les volailles pouvant être soit immunisées In soit malades Mn soit ni l’un ni l’autre Vn d’’évidence In+Mn+Vn=k où k représente l’effectif des volailles il s’en suit que In/k+Mn/k+Vn/k=p(In)+p(Mn)+p(Vn)=in+mn+vn=1 2———————————— p(V0)=v0=1 ==> I0=m0=0 constitution de l’arbre entre la semaine n et n+1 Par lecture sur l’arbre mn+1=0.6*mn+0.09*mn 3———————————— C3=0,6*C2+0.09*D2 4a———————————— Par lecture sur l’arbre vn+1=0,78*vn suite géométrique de raison 0.78 et de premier terme 1 ==> vn=0.78^n 4b———————————— relation mn=(0,78^n-0.6^n)/2 vérifiée à l’ordre 1, supposée vérifiée à l’ordre n ==> mn=(0,78^n-0.6^n)/2 à l’ordre n+1 mn+1=0.6*mn+0.09*mn=0.6*(0,78^n-0.6^n)/2+0*09*0.78^n=(0.6*(0,78^n-0.6^n)+0*18*0.78^n)/2=(0,78^(n+1)-0.6^(n+1))/2 la relation est démontrée à l’ordre n+1, donc héréditaire et valide pour toute valeur de n 5———————————— lorsque n-> ∞ alors Vn et mn ->0 donc In=1 et toutes les poules sont immunisée
-

Dosage de l’anhydride sulfureux SO2 dans un vin mousseux
Barbidoux a répondu à un(e) sujet de loulou34212 dans Sciences
Exercice 3 : Dosage de l’anhydride sulfureux SO2 dans un vin mousseux Dans l’Antiquité déjà, les Romains et les Egyptiens utilisaient le dioxyde de soufre pour conserver les denrées alimentaires. Le SO2 sert comme antiseptique, antioxydant et comme régulateur de fermentation. Un excès de SO2 dans le vin a pour effet de provoquer des maux de tête ; en France, la concentration maximale est de 0,225 g.L-1. Le SO2 apporté au vin se présente sous deux formes : la forme libre en solution SO2(aq) susceptible d’intervenir vis-à-vis des levures et surtout des bactéries et le SO2 combiné à une molécule d’éthanal du vin sous forme de CH3CHOHSO3H. Les mesures de la quantité totale de SO2 et du SO2 sous forme libre constituent deux paramètres du rapport d’analyse d’un vin. Pour mesurer la quantité de forme libre SO2 (aq), on va réaliser un dosage d’oxydo-réduction de SO2 par du diiode de coloration brune. Pour doser la totalité du SO2, on libère le SO2 combiné à l’éthanal en ajoutant une solution concentrée de soude puis, après retour en milieu acide, on dose le SO2(aq) total par du diiode. Mode opératoire du dosage Introduire dans un erlenmeyer VB = 20,0 mL de vin blanc mousseux préalablement dégazé puis ajouter 20 mL de soude de concentration 1,0 mol.L-1. Agiter et laisser agir pendant 15 minutes pour permettre la libération du SO2. Ajouter ensuite 6 mL d’acide sulfurique à 6 mol.L-1 et une pincée d’empois d’amidon (indicateur de fin de réaction). Doser le contenu de l’erlenmyer par une solution de diiode de concentration CA = 2,00.10-3 mol.L-1. On note VA,éq le volume équivalent quand la coloration bleue persiste : VA,éq = 17,0 mL. 1. Écrire la réaction du dosage. On donne les couples rédox : I2(aq) / I-(aq) ; SO4(aq) / SO2 (aq) (1 point) Exercice 3 : Dosage de l’anhydride sulfureux SO2 dans un vin mousseux Dans l’Antiquité déjà, les Romains et les Egyptiens utilisaient le dioxyde de soufre pour conserver les denrées alimentaires. Le SO2 sert comme antiseptique, antioxydant et comme régulateur de fermentation. Un excès de SO2 dans le vin a pour effet de provoquer des maux de tête ; en France, la concentration maximale est de 0,225 g.L-1. Le SO2 apporté au vin se présente sous deux formes : la forme libre en solution SO2(aq) susceptible d’intervenir vis-à-vis des levures et surtout des bactéries et le SO2 combiné à une molécule d’éthanal du vin sous forme de CH3CHOHSO3H. Les mesures de la quantité totale de SO2 et du SO2 sous forme libre constituent deux paramètres du rapport d’analyse d’un vin. Pour mesurer la quantité de forme libre SO2 (aq), on va réaliser un dosage d’oxydo-réduction de SO2 par du diiode de coloration brune. Pour doser la totalité du SO2, on libère le SO2 combiné à l’éthanal en ajoutant une solution concentrée de soude puis, après retour en milieu acide, on dose le SO2(aq) total par du diiode. Mode opératoire du dosage Introduire dans un erlenmeyer VB = 20,0 mL de vin blanc mousseux préalablement dégazé puis ajouter 20 mL de soude de concentration 1,0 mol.L-1. Agiter et laisser agir pendant 15 minutes pour permettre la libération du SO2. Ajouter ensuite 6 mL d’acide sulfurique à 6 mol.L-1 et une pincée d’empois d’amidon (indicateur de fin de réaction). Doser le contenu de l’erlenmyer par une solution de diiode de concentration CA = 2,00.10-3 mol.L-1. On note VA,éq le volume équivalent quand la coloration bleue persiste : VA,éq = 17,0 mL. 1. Écrire la réaction du dosage. On donne les couples rédox : I2(aq) / I-(aq) ; SO4^(2-)(aq) / SO2 (aq) (1 point) ————————— équations électrochimiques correspondant aux couples endos I2(aq) +2*e^(-)= 2*I^(-)(aq) SO4^(2-)+4*H^(+)+2*e^(-)=SO2(aq)+2*H2O réaction du dosage SO2(aq)+2*H2O+I2(aq)=SO4^(2-)+4*H^(+)+ 2*I^(-)(aq) ————————— 2. Avant le début du titrage, quel est le volume total de solution présent dans l’erlenmeyer ? On notera Vtot le volume de la solution. (0,5 point) ————————— 20+20+6 ————————— 3. Réaliser un schéma du montage permettant d’effectuer le titrage. (0,5 point) ————————— ————————— 4. Comment repère-ton l’équivalence ? Préciser la couleur du mélange avant et après l’équivalence, et à l’équivalence. (0,75 point) ————————— Avant équivalence couleur jaune pâle du vin mousseux dilué, une goutte après l’équivalence couleur bleue de l’amidon au contact d’un excès d’iode ————————— 5. En déduire la relation d’équivalence. (1 point) ————————— n(SO2)=n(I2) <==> C(SO2)*V(Vin)=C(I2)*Veq ————————— 6. Calculer la concentration en SO2en g.L-1. (1 point) ————————— C(SO2)=C(I2)*Veq/*V(Vin)=20*2*10^(-3)/17=2.35*10^(-3) mol/L=2.35*10^(-3)*(2*32+16)=0.188 g/L ————————— 7. Ce vin respecte-t-il les normes ? (1,25 point) Il respecte les normes Françaises Données : M(O) = 16,0 g.mol-1 ; M(S) = 32,1 g.mol-1. -
comme sur les calculatrices ^ = puissance ou exposant 2^3=23
-
Exercice 2 : l’or (10 pts) Un lingot d’or de masse 1,00 kg occupe un volume de 52,5 mL. Données : l’or cristallise dans une structure c.f.c. La masse d’un atome d’or est m = 3,27×10−22 g 1. Démontrer que la masse volumique de l’or est ρ = 1,9.104 kg/m³(1 pt). Calculer sa densité d (1 pt). ---------------- rho=m1/V=1.00/(52.5*10^(-6))=1912.5=1.905 kg/m^3 d=rho/rho°(H2O)=1.905 ---------------- 2. Démontrer que le rayon atomique de l’or est r = 1,4.10-10 m (3 pts). ---------------- L’or cristallise dans une structure c.f.c.. La maille élémentaire de l'or contient 8*(1/8)+6*1/2=4 atomes d'or. Les atomes des faces sont jointifs. Si a est le paramètre de maille, r le rayon de l'atome d'or alors 4*r=a*√2 ==> r=a*√2/4 rho=m/V=4*m/a^3 ==> a= (4*m/rho)^(1/3)==> r= (4*m/rho)^(1/3)*√2/4=(4*3.27*10^(-25)/19047.5)^(1/3)*√2/4=1.448*10^(-10) m ---------------- 3. Rappeler la valeur de la compacité d’une maille c.f.c. et utiliser sa définition pour démontrer que le paramètre a de la maille est 400 pm (3,5 pts). Toute autre démonstration n’utilisant pas la définition et la valeur de la compacité est acceptée. ---------------- De la relation a= (4*m/rho)^(1/3)==(4*3.27*10^(-25)/19047.5)^(1/3)=4.095 10^(-10)m=409.5 pm ---------------- 4. Les atomes d’or sont disposés en couches ABCABC. Calculez la distance entre deux plans consécutifs d’atomes d’or au contact. (1,5 pts) ---------------- Il manque la définition des couches A,B et C (coordonnées des plans considérés) ----------------
-
Elle te sont données dans l'énoncé.... échelle 1 cm pour 10 km, donc sur le schéma l'antenne A a pour coordonnées A{3,5} (centre du cercle). Louane est à 30 km de cette antenne donc sur un cercle de 3 cm de rayon.
-
SalutDenis
Dans ta réponse
3) Quand la balle touche le sol, sa hauteur, donc h(x) est nulle. Résous h(x) = 0. Est-ce que c'est avant C ?
Je ne crois pas qu'elle soit capable de résoudre cette équation à son niveau (3èm). Le plus simple selon moi serrait pour elle de calculer l'image de 18 par h et d'en tirer les conclusions qui s'imposent.
Je te souhaite une bonne soirée
Amitiés
Bernard Le Gorrec -
On peut (c'est le niveau de raisonnement le plus simple) compter le nombre des cartes (2 pour 1 étage 7 pour 2 étages 15 pour 3 étages etc…) ce qu'à proposé Denis. Pour aller plus loin on peut compter le nombre de cartes nécessaire à la constitution de chacun des étages du château et remarquer que tout ajout d'un étage supplémentaire nécessite trois cartes de plus que celles nécessaires pour constituer le l'étage précédent …. Ainsi il faut il faut 2 cartes pour réaliser le premier étage, 2+3=5 pour réaliser le second, 5+3 pour le troisième etc… Donc pour un château de 3 étage il faudra un nombre N de cartes égal à N=2+5+8=15 cartes et pour un château de 6 étages il faudra un nombre N de cartes égal à N=2+5+8+11+14+17=57 cartes Je pense qu'au niveau de la cinquième cela reste encore compréhensible. C'este ensuite que cela se gâte d'où mon intervention. Pour un nombre n d'étage il faudra faire la somme de n nombres en partant de 2, chaque nombre suivant étant égal au précédant auquel on ajoute 3 ce qui donnera N=2+5+8+11+14+…….. jusqu'à ce que l'on ait n nombres on voit comment faire mais cela ne donne toujours pas le nombre de cartes nécessaire. Ce nombre ne peut être obtenu qu'en utilisant des expressions que l'on ne voit que dans des classes de niveau beaucoup plus élevé. C'est la raison pour la quelle il me semble impossible (en cinquième) de donner le nombre N des cartes nécessaires pour réaliser un château d'un nombre n quelconque d'étages (et qui vaut N=(3*n^2+n)/2).
-
Et bien tu ne peux pas résoudre cet exercice en cinquième.... Tu peux éventuellement trouver combien de cartes il te faut pour faire un château de 6 étages mais un château d'un nombre quelconque n d'étages j'en serais fort surpris.