loulou34212
Membres-
Compteur de contenus
115 -
Inscription
-
Dernière visite
-
Jours gagnés
1
Type de contenu
Profils
Forums
Blogs
Galerie
Boutique
Tout ce qui a été posté par loulou34212
-
salut tous le monde j'ai besoin d aide svp je suis pas sur de ma réponse On prélève 2,5 mL d’une solution de jus de fruit que l’on verse dans une fiole jaugée de 50 mL. On y ajoute 20,0 mLd’une solution colorée de diiode, de concentration [I2(aq)] = 2,5.10–2 mol.L–1 . On complète au trait de jauge par une solution d’hydroxyde de sodium afin de maintenir un excès d’ions hydroxyde dans le milieu réactionnel. Quelle est la quantité de matière nD de diiode initialement introduit ? j'ai trouvée 5,0.10-4
-
merci baeucoup pour ton aide mais j ai pas compris le 5 peux tu m aider pour l exercice 3 le 3 4 5 s'il te plait
-
oups je suis désolée j'ai poster le devoir entier mais j'ai besoin d'aide que pour l exercice 3 question 3 4 5 et l'exercice 4 svp je dois rendre ce devoir rapidement svp et merci d'avance
-
bonjour a tous j'ai besoin d'aide svp CAPTURE DEVOIR 5.pdf
-
est elle valable pour tout triangle ABC ? ET POUR LA 4 ? j ai besoin d aide pour l'exercice 3 question 3 4 5 EXERCICE 4 CAPTURE DEVOIR 5.pdf
-
-
Salut est ce que tu as la correction de ce devoir ou pas ?
-
salut tous le monde j'ai besoin de votre aide svp merci d'avance Sous un climat chaud-humide, le corps essaie de lutter en envoyant plus de sang vers ses régions périphériques et déclenche un état de léthargie. Quelles sont les conséquences sur le bilan thermique corporel de ces deux actions ? (2,5 points)
-
-
pour le a) j'ai mis : quantité d'humidité b) c) la vitesse de réaction aurait augmenter d)
-
-
bonjour Exercice 3 : Dosage de l’anhydride sulfureux SO2 dans un vin mousseux Dans l’Antiquité déjà, les Romains et les Egyptiens utilisaient le dioxyde de soufre pour conserver les denrées alimentaires. Le SO2 sert comme antiseptique, antioxydant et comme régulateur de fermentation. Un excès de SO2 dans le vin a pour effet de provoquer des maux de tête ; en France, la concentration maximale est de 0,225 g.L-1. Le SO2 apporté au vin se présente sous deux formes : la forme libre en solution SO2(aq) susceptible d’intervenir vis-à-vis des levures et surtout des bactéries et le SO2 combiné à une molécule d’éthanal du vin sous forme de CH3CHOHSO3H. Les mesures de la quantité totale de SO2 et du SO2 sous forme libre constituent deux paramètres du rapport d’analyse d’un vin. Pour mesurer la quantité de forme libre SO2 (aq), on va réaliser un dosage d’oxydo-réduction de SO2 par du diiode de coloration brune. Pour doser la totalité du SO2, on libère le SO2 combiné à l’éthanal en ajoutant une solution concentrée de soude puis, après retour en milieu acide, on dose le SO2(aq) total par du diiode. Mode opératoire du dosage Introduire dans un erlenmeyer VB = 20,0 mL de vin blanc mousseux préalablement dégazé puis ajouter 20 mL de soude de concentration 1,0 mol.L-1. Agiter et laisser agir pendant 15 minutes pour permettre la libération du SO2. Ajouter ensuite 6 mL d’acide sulfurique à 6 mol.L-1 et une pincée d’empois d’amidon (indicateur de fin de réaction). Doser le contenu de l’erlenmyer par une solution de diiode de concentration CA = 2,00.10-3 mol.L-1. On note VA,éq le volume équivalent quand la coloration bleue persiste : VA,éq = 17,0 mL. 1. Écrire la réaction du dosage. On donne les couples rédox : I2(aq) / I-(aq) ; SO4 2-(aq) / SO2 (aq) (1 point) 2. Avant le début du titrage, quel est le volume total de solution présent dans l’erlenmeyer ? On notera Vtot le volume de la solution. (0,5 point) 3. Réaliser un schéma du montage permettant d’effectuer le titrage. (0,5 point) 4. Comment repère-ton l’équivalence ? Préciser la couleur du mélange avant et après l’équivalence, et à l’équivalence. (0,75 point) 5. En déduire la relation d’équivalence. (1 point) 6. Calculer la concentration en SO2en g.L-1. (1 point) 7. Ce vin respecte-t-il les normes ? (1,25 point) Données : M(O) = 16,0 g.mol-1 ; M(S) = 32,1 g.mol-1.
-
bonjour j'ai besoin d'aide svp j'ai fait que la 1 pour le moment Exercice 1 : Combustion d’un carburant (6 points) Un des constituants principaux de l’essence est l’heptane, alcane de formule brute C7H16. Un réservoir de voiture contient 47 L d’essence que l’on assimilera à l’heptane pur. On admettra que la carburation est parfaite c’est-à-dire que l’essence est intégralement brûlée dans le dioxygène, et qu’il se forme exclusivement du dioxyde de carbone et de la vapeur d’eau. Ecrire les résultats avec 3 chiffres significatifs. 1. Écrire l’équation chimique modélisant la réaction. (1 point) 2. Quelle est la quantité de matière d’heptane utilisée lors de la combustion de la moitié du réservoir ? (1,5 points) 3. À l’aide d’un tableau d’avancement, quel est le volume de dioxygène nécessaire à la combustion de la moitié du réservoir ? (2 points) 4. Quel est le volume de dioxygène nécessaire à la combustion de la totalité du réservoir ? (1 point) 5. Quel est alors le volume de dioxyde de carbone (pour la totalité) ? (0,5 point) Données : Volume molaire (exclusivement pour les gaz) dans les conditions de l'expérience : 25 L.mol-1. Masse molaire de l’heptane C7H16 : 100 g.mol. -1 Masse volumique de l’heptane ρ = 0,684 kg.L-1
-
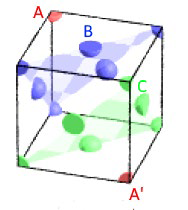
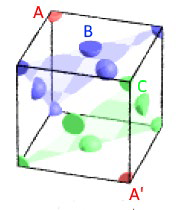
bonjour quelqu'un pourrais m'aider svp Les atomes d’or sont disposés en couches ABCABC. Calculez la distance entre deux plans consécutifs d’atomes d’or au contact.
-
bonjour tous le monde j'ai besoin de votre aide svp je n'arrive vraiment pas 1) L’albédo terrestre vaut 31 % en moyenne et le flux réfléchi ou diffusé par la Terre vers l’espace vaut 107 W/m² environ. Calculez la température caractéristique de l’émission thermique du système « Terre+atmosphère » (température au sommet de l’atmosphère). Rappel : d’après la loi de Stefan-Boltzmann, l’émittance du rayonnement thermique, caractéristique d’une source de type « corps noir », s’écrit : F=σxT4 Avec σ=5,67x10−8W/m²/K choisir une réponse : a. 254 K b. 354 K c. 122 K 2) L’albédo terrestre vaut 31 % en moyenne et le flux réfléchi ou diffusé par la Terre vers l’espace vaut 107 W/m² environ. De plus, l’effet de serre s’élève à 155 W/m² en moyenne. Calculez la température caractéristique de l’émission thermique de la surface de la Terre (température à la surface). Rappel : d’après la loi de Stefan-Boltzmann, l’émittance du rayonnement thermique, caractéristique d’une source de type « corps noir », s’écrit : F=σxT4 Avec σ = 5,67 x 10^{-8} W/m²/K^4 choisir une réponse : a. 288 K b. 254 K c. 155 K merci d'avance
-
-
salut à tous j'ai vraiment besoin de votre aide je dois rapidement terminée ce devoir svp 1 L’albédo terrestre vaut 31 % en moyenne et le flux réfléchi ou diffusé par la Terre vers l’espace vaut 107 W/m² environ. Calculez la température caractéristique de l’émission thermique du système « Terre+atmosphère » (température au sommet de l’atmosphère). Rappel : d’après la loi de Stefan-Boltzmann, l’émittance du rayonnement thermique, caractéristique d’une source de type « corps noir », s’écrit : F=σxT4 Avec σ=5,67x10−8W/m²/K4 choisir une réponse : a. 254 K b. 354 K c. 122 K 2 L’albédo terrestre vaut 31 % en moyenne et le flux réfléchi ou diffusé par la Terre vers l’espace vaut 107 W/m² environ. De plus, l’effet de serre s’élève à 155 W/m² en moyenne. Calculez la température caractéristique de l’émission thermique de la surface de la Terre (température à la surface). Rappel : d’après la loi de Stefan-Boltzmann, l’émittance du rayonnement thermique, caractéristique d’une source de type « corps noir », s’écrit : F=σxT4 Avec σ = 5,67 x 10^{-8} W/m²/K^4 Veuillez choisir une réponse : a. 288 K b. 254 K c. 155 K
-
j'ai mis la b est ce que c'est juste ?
-
quelle est la bonne réponse Le spectre d’émission thermique, dit du « corps noir », est caractérisé par : a. un seul maximum b. de fines raies d’émission c. de fines raies d’absorption
-
bonjour j'ai vraiment besoin d'aide sur cet exercice svp Exercice 2 : l’or (10 pts) Un lingot d’or de masse 1,00 kg occupe un volume de 52,5 mL. Données : l’or cristallise dans une structure c.f.c. La masse d’un atome d’or est m = 3,27×10−22 g 1. Démontrer que la masse volumique de l’or est ρ = 1,9.104 kg/m³(1 pt). Calculer sa densité d (1 pt). 2. Démontrer que le rayon atomique de l’or est r = 1,4.10-10 m (3 pts). 3. Rappeler la valeur de la compacité d’une maille c.f.c. et utiliser sa définition pour démontrer que le paramètre a de la maille est 400 pm (3,5 pts). Toute autre démonstration n’utilisant pas la définition et la valeur de la compacité est acceptée. 4. Les atomes d’or sont disposés en couches ABCABC. Calculez la distance entre deux plans consécutifs d’atomes d’or au contact. (1,5 pts)
-
Ah oui j'ai oublier de l'écrire voila la réaction entre l’oxyde de fer et le monoxyde de carbone Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO2(g) l'énoncé : Le fer ne se trouve pas à l’état Fe(s) dans la nature mais sous la forme d’oxyde de fer tel que Fe2O3(s) qui se trouve dans des minerais. Il est donc nécessaire transformer l’oxyde de fer en présence de monoxyde de carbone obtenu par combustion du coke qui est un dérivé du charbon. Pour cela, la réaction a lieu dans des hauts fourneaux qui permettent de monter à des températures entre 700 et 900°C. Une telle installation peut fournir plusieurs milliers de tonnes de fer (fonte) par jour
-
salut j'ai besoin d'aide svp pour cette question Peut-on calculer la durée de vie d’un noyau radioactif individuel en connaissant sa demi-vie ? justifiez
-
bonjour j'ai besoin d'aide svp ex 1 On introduit un échantillon de m = 3,2 tonnes de minerai de fer dans les hauts fourneaux. Quelle est la quantité de matière correspondante ? Masse molaire de l’oxygène M(O) = 16,0 g.mol-1 ; masse molaire du fer M(Fe) = 56,0 g.mol-1. n = 2,0.107 mol n = 2,0.104 mol n = 5,1.108 mol ex 2 Lors de l’ exploitation, les conditions opératoires sont à pression atmosphérique et à une température de 700 °C. Le volume molaire des gaz est Vm = 80 L.mol-1. Calculer le volume de monoxyde de carbone consommé lors de cette transformation. Veuillez choisir une réponse : 750 L 1,6.106 L 4,8.106 L
-
bonjour tous le monde j'ai vraiment besoin d'aide pour la suite de mon dm je n'arrive vraiment pas svp Pour écrire un message secret, il est possible de tremper un coton tige dans une solution aqueuse jaune orangée de diiode I2(aq), et une fois le message écrit, on le masque en recouvrant la feuille de jus de citron. Après séchage, en vaporisant du peroxyde d’hydrogène H2O2(aq), le destinataire peut lire le message en le faisant réapparaître. Le jus de citron est considéré comme une solution d’acide ascorbique C6H8O6(aq). Données : couples oxydant/réducteur : I2(aq) / I-(aq) C6H6O6(aq)/ C 6H8O6(aq) H2O2(aq) / H2O(l) O2(g)/H2O2(aq) Quelles sont les demi-équations des espèces impliquées dans la réaction d’oxydoréduction conduisant à la disparition du message ? Veuillez choisir au moins une réponse : I2(aq) + 2 e- = 2 I-(aq) H2O2(aq) + 2 H+(aq) + 2 e- = 2 H2O(l) O2(g) + 2 H+(aq) + 2 e- = H2O2(aq) C6H6O6(aq) + 2 H+(aq) + 2 e- = C6H8O6(aq) Parmi les équations suivantes, laquelle correspond à la réaction d’oxydoréduction lors de la disparition du message ? Veuillez choisir une réponse : I2(aq) + C6H8O6(aq) = 2 I-(aq) + C6H6O6(aq) + 2 H+(aq) I2(aq) + C6H8O6(aq) + 2 e- → 2 I-(aq) + C6H6O6(aq) + 2 H+(aq) + 2 e- I2(aq) + C6H8O6(aq) → 2 I-(aq) + C6H6O6(aq) + 2 H+(aq) Quelles sont les demi-équations des espèces impliquées dans la réaction d’oxydoréduction conduisant à la réapparition du message ? Veuillez choisir au moins une réponse : I2(aq) + 2 e- = 2 I-(aq) H2O2(aq) + 2 H+(aq) + 2 e- = 2 H2O(l) O2(g) + 2 H+(aq) + 2 e- = H2O2(aq) C6H6O6(aq) + 2 H+(aq) + 2 e- = C6H8O6(aq) Parmi les équations suivantes, laquelle correspond à la réaction d’oxydoréduction lors de la disparition du message ? Veuillez choisir une réponse : 2 I-(aq) + H2O2(aq) + 2 H+(aq) + 2 e- → I2(aq) + 2 H2O(l) + 2 e- 2 I-(aq) + H2O2(aq) + 2 H+(aq) → I2(aq) + 2 H2O(l) 2 I-(aq) + H2O2(aq) + 2 H+(aq) = I2(aq) + 2 H2O(l)
-
BONJOUR j'ai besoin d'aide pour mon devoir de physique svp Depuis une dizaine d’années, glucose, bactéries ou plantes inspirent les chercheurs en quête d’une source d’énergie alternative et propre. Les biopiles convertissent l’énergie chimique en énergie électrique, mais à l’inverse de la pile chimique, les composants de la biopile sont 100 % naturels. Ce dispositif de quelques millimètres fait réagir le dioxygène et le sucre, présents dans le liquide physiologique du corps. Dans un premier compartiment, le dioxygène est placé, et dans un second, le glucose se trouve. Cette transformation, qui libère des électrons, conduit à la production de courant électrique pouvant notamment faire fonctionner un pacemaker. Données : couples oxydant-réducteur : O2(aq)/H2O(l) et C6H10O6(aq)/C6H12O6(aq). Question 8 Quelle est la demi-équation correspondant au couple O2(aq)/H2O(l) ? Veuillez choisir une réponse : O2(aq) + 4 H+(aq) = 2 H2O(l) O2(aq) + 4 H+(aq) + 4 e- = 2 H2O(l) 2 O2(aq) + 8 H+(aq) = 4 H2O(l) Question 9 Quelle est la demi-équation correspondant au couple C6H10O6(aq)/C6H12O6(aq) ? Veuillez choisir une réponse : 2 C6H10O6(aq) + 2 H2O(l) = 2 C6H12O6(aq) + O2(aq) C6H10O6(aq) + 2 H+(aq) = C6H12O6(aq) C6H10O6(aq) + 2 H+(aq) + 2 e- = C6H12O6(aq) Question 10 Entre le glucose et le dioxygène, qui joue le rôle de réducteur ? Qui joue le rôle d’oxydant ? Veuillez choisir au moins une réponse : Le glucose est l’oxydant. Le dioxygène est un réducteur. Le glucose est un réducteur. Le dioxygène est un oxydant. Question 11 Les deux demi-équations des couples impliqués sont : O2(aq) + 4 H+(aq) + 4 e- = 2 H2O(l) C6H10O6(aq) + 2 H+(aq) + 2 e- = C6H12O6(aq) Quelle est l’équation de la réaction modélisant la transformation ayant lieu dans la biopile ? Veuillez choisir une réponse : O2(aq) + 2 C6H10O6(aq) + 8 H+(aq) → 2 H2O(l) + 2 C6H12O6(aq) O2(aq) + 2 C6H12O6(aq) → 2 H2O(l) + 2 C6H10O6(aq) O2(aq) + 2 C6H12O6(aq) + 4 H+(aq) → 2 H2O(l) + 2 C6H10O6(aq) + 4 H+(aq) Question 12 Dans cette biopile, il s’agit de quel type de transfert d’électrons ? Veuillez choisir une réponse : Transfert direct Transfert indirect Transfert unique Question 13 Déterminer le compartiment par lequel sortent les électrons. Veuillez choisir une réponse : Les électrons sortent du compartiment dans lequel se trouve le dioxygène. Les électrons sortent du compartiment dans lequel se trouve le glucose. Les électrons sont transférés directement dans la solution. mes réponses : 8) O2(aq) + 4 H+(aq) + 4 e- = 2 H2O(l) 9) 10) le glucose est l'oxydant /le dioxygène est un réducteur 11) 12) 13) merci d'avance



.thumb.png.410394494ec5f8ae44e7a4c6590841e1.png)
.thumb.png.a563065655489e81690f4cb160097abd.png)
.thumb.png.0f112a3fb4cd8771368a0193f65fa114.png)
.thumb.png.47b76461012717195247a7ad2515e265.png)